Qué pasa si Kc es igual a Kp: ¿Cómo afecta la reacción química?
¿Qué pasa si Kc es igual a Kp? es una pregunta común entre los estudiantes de química y puede ser un poco confusa al principio. En términos generales, ambas constantes de equilibrio están relacionadas con la posición del equilibrio químico en una reacción. Pero, ¿qué sucede cuando los valores de Kc y Kp son iguales? En este artículo, exploraremos las implicaciones de esta igualdad y cómo afecta la reacción química.
Para entender completamente las implicaciones de que Kc y Kp sean iguales, primero debemos repasar qué son estas constantes y cómo se relacionan con la reacción química. Kc representa la constante de equilibrio basada en las concentraciones de los productos y reactivos en una reacción química, mientras que Kp se refiere a la constante de equilibrio basada en las presiones parciales de los gases involucrados en la reacción.
¿Qué significa que Kc sea igual a Kp?
En una reacción química, la constante de equilibrio es una medida de la relación entre los productos y los reactivos en el estado de equilibrio. La constante de equilibrio puede expresarse en términos de concentraciones molares (Kc) o en términos de presiones parciales (Kp). Kc y Kp están relacionados por una ecuación que depende del equilibrio químico y las condiciones del sistema. Cuando Kc es igual a Kp, la reacción se encuentra en equilibrio y la concentración de productos y reactivos son iguales tanto en términos de molares como de presiones parciales.
En otras palabras, si Kc es igual a Kp, la reacción química está en equilibrio y no hay cambios netos en la concentración de productos o reactivos. Esto no significa que la reacción se detenga, sino que la velocidad de la reacción hacia los productos es igual a la velocidad de la reacción hacia los reactivos. Es importante tener en cuenta que una reacción química no siempre alcanza el equilibrio, y que las condiciones del sistema pueden afectar la constante de equilibrio.
¿Cómo afecta la concentración de los reactivos y productos a Kc y Kp?
La concentración de los reactivos y productos en una reacción química tiene un impacto directo en los valores de Kc y Kp. En general, cuando la concentración de los reactivos aumenta, la concentración de los productos disminuye y viceversa. Esto se debe al principio de Le Chatelier, que establece que cuando un sistema en equilibrio es sometido a una perturbación, éste se ajusta para contrarrestar la perturbación y volver al equilibrio.
Si la concentración de los reactivos aumenta, la reacción se desplazará hacia la formación de más productos para contrarrestar el exceso de reactivos. Como resultado, el valor de Kc y Kp aumentará. Por otro lado, si la concentración de los productos aumenta, la reacción se desplazará hacia la formación de más reactivos para contrarrestar el exceso de productos, lo que dará lugar a una disminución del valor de Kc y Kp.
La concentración de los reactivos y productos puede afectar significativamente los valores de Kc y Kp. Es importante tener en cuenta que este efecto solo se aplica a reacciones reversibles en equilibrio, y que otros factores, como la temperatura y la presión, también pueden tener un impacto en estos valores.
La concentración de los reactivos y productos es un factor clave a considerar en el cálculo de Kc y Kp en una reacción química reversible.
¿Cómo influye la temperatura en Kc y Kp?
La temperatura es uno de los factores que influyen en el valor de Kc y Kp. En general, un aumento en la temperatura favorece la reacción endotérmica y disminuye la reacción exotérmica.
Por ejemplo, si tenemos la reacción:
A + B ⇌ C + D
donde ΔH es positivo, un aumento en la temperatura aumenta la concentración de los productos y disminuye la concentración de los reactivos, lo que implica un aumento en el valor de Kc y Kp.
Otro ejemplo es si tenemos la reacción:
2NO2(g) ⇌ N2O4(g)
donde ΔH es negativo, un aumento en la temperatura disminuye la concentración de los productos y aumenta la concentración de los reactivos, lo que implica una disminución en el valor de Kc y Kp.
¿Qué sucede con la reacción si Kc es mayor que Kp o viceversa?
Si Kc y Kp son iguales, significa que la presión parcial de cada gas en la reacción es igual a su concentración molar. Esto implica que la reacción se encuentra en equilibrio y no hay cambio en la cantidad de producto o reactante.
Ahora bien, si Kc es mayor que Kp, significa que la concentración de productos en la reacción es mayor que lo que se espera en el equilibrio. Esto indica que la reacción se desplazará hacia los reactantes para alcanzar un equilibrio. Por otro lado, si Kp es mayor que Kc, significa que la presión parcial de los productos es mayor de lo que se espera en el equilibrio, lo que indica que la reacción se desplazará hacia los productos para alcanzar un equilibrio.
Cuando Kc es igual a Kp, la reacción química se encuentra en equilibrio y las concentraciones de los reactivos y productos son estables. Esto significa que la reacción puede proceder en ambas direcciones con la misma velocidad y la cantidad de sustancias presentes no cambia con el tiempo.
Es importante tener en cuenta que el equilibrio químico es un concepto fundamental en la química y es necesario comprenderlo para entender cómo las reacciones químicas se comportan en diferentes condiciones.
 ¿Qué pasa si KC es igual a KP Index? Descubre la respuesta aquí
¿Qué pasa si KC es igual a KP Index? Descubre la respuesta aquí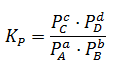 Qué sucede si KC es igual a KP máximo: todo lo que necesitas saber
Qué sucede si KC es igual a KP máximo: todo lo que necesitas saberSi quieres conocer otros artículos parecidos a Qué pasa si Kc es igual a Kp: ¿Cómo afecta la reacción química? puedes visitar la categoría Educación.

Deja una respuesta